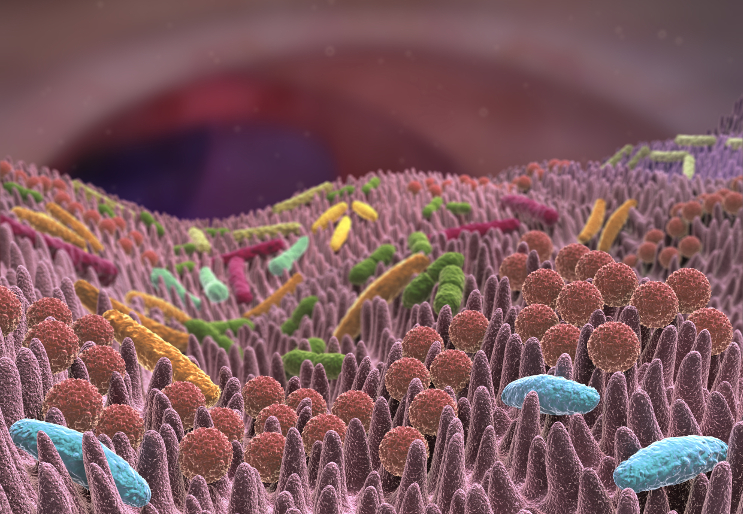
Ce travail brillant étaye aussi la relation linéaire, chez l’Homme, entre élévation permanente de la glycémie et perméabilité intestinale aux bactéries du microbiote. Les muqueuses sont des barrières efficaces contre les bactéries des microbiotes locaux : intestinal, respiratoire, vaginal…Mais, chez les personnes souffrant seulement d’un syndrome métabolique dont les conséquences sont souvent minimisées par rapport à un diabète installé (type 1 ou 2), l’intestin est perméable à ces germes, ce qui entraîne des infections et diverses inflammations générales durables. Dans cette situation, les cellules intestinales laissent passer les bactéries parce qu’elles ne sont plus bien attachées entre elles, par exemple par des jonctions serrées (tight junctions en anglais). Ces jonctions sont comme des points de colle entre les membranes de cellules voisines ; elles ne laissent rien passer en temps normal. Quand elles s’altèrent l’épithélium intestinal devient poreux et ne fait plus barrière contre les bactéries du microbiote.
En utilisant plusieurs modèles de souris, Christoph Thaiss et ses collaborateurs ont exploré les mécanismes de cette perméabilité (article paru dans Science, mars 2018)1. Leur méthode consiste à explorer chaque étape du mécanisme cellulaire en utilisant des organismes entiers dont les cellules sont mutées spécifiquement au niveau d’un seule gène. Le modèle « corps entier » est nécessaire pour apprécier le fonctionnement en vie réelle. On utilise souvent les souris car elles se multiplient vite, sont petites et faciles à élever et d’une physiologie proche de l’Homme.
En multipliant les explorations dans plusieurs lignées de souris, les chercheurs ont pu isoler les étapes altérées. Ils ont d’abord étudié un facteur lié à l’obésité, la leptine, un messager secrété par les cellules graisseuses suspecté d’agir sur le tube digestif. D’après leurs résultats, la leptine n’est pas véritablement en cause ; c’est seulement un facteur favorisant de la dégradation digestive, et l’obésité n’est pas nécessaire pour avoir un intestin perméable. Ils constatent :
- que le risque infectieux intestinal est commun à toutes les situations où l’hyperglycémie est permanente ;
- que ce risque disparaît dans toutes les situations où la glycémie est normale.
Ces deux faits confirment l’implication de l’hyperglycémie.
Pour le prouver expérimentalement, l’équipe de Christoph Thaiss a traqué les effets cellulaires du glucose chez des souris diabétiques de type 1 non obèses. Premier constat : le microbiote intestinal de chaque souris fournit bien les bactéries des infections qu’on observe ; ce sont les mêmes. Deuxième constat : lors d’une hyperglycémie prolongée, le microbiote se modifie et les bactéries deviennent plus agressives. Toutefois, ce n’est pas cela qui dégrade la barrière intestinale. On le vérifie en traitant par insuline les souris : cela suffit à corriger immédiatement le risque infectieux, la perméabilité digestive et le passage bactérien dans le sang. Une action si rapide ne peut être due à une modification du microbiote, qui demande plus de temps.
En étudiant la machinerie cellulaire par séquençage génétique, l’équipe de recherche a découvert plus de 1000 gènes affectés par l’excès de glucose dans les cellules intestinales, avec une altération génétique proportionnelle à l’hyperglycémie. Il se trouve que la majorité de ces gènes concerne l’intégrité de la barrière épithéliale digestive. Banco ! On y trouve le gène d’un transporteur membranaire du glucose appelé GLUT2. Sans ce transporteur, les souris diabétiques ne sont plus sensibles à l’hyperglycémie et ne montrent plus d’altération intestinale, les jonctions cellulaires restent intactes et les particules bactériennes passent beaucoup moins dans le sang.
Qu’en est-il chez l’Homme ?
Pour répondre à cette question les chercheurs ont étudié 27 personnes en bonne santé. Leur perméabilité intestinale suit le niveau moyen de leur glycémie, comme chez les souris. Et leur hémoglobine glyquée (HbA1c) (témoin de la glycémie moyenne) se révèle proportionnelle au nombre de particules bactériennes intestinales retrouvées dans le sang, comme chez les souris aussi.
Au total, par ce travail considérable et convaincant, les auteurs amorcent une explication globale des multiples dégradations d’organes lors d’une élévation durable de la glycémie, mécanisme pathologique du diabète. En effet, le trouble du fonctionnement des gènes cellulaire provoqué par l’hyperglycémie est un processus commun a priori à toutes les cellules. Cette étude explique en premier lieu les infections « microbiotiques » chez les patients hyperglycémiques.
En démontrant le danger infectieux de l’hyperglycémie, ce travail de recherche confirme la nécessité d’un taux de sucre sanguin strictement encadré chez les êtres vivants.
Source : Christoph A. Thaiss, Maayan Levy, Inna Grosheva, Danping Zheng, Eliran Soffer, Eran Blacher, Sofia Braverman, Anouk C. Tengeler, Oren Barak, Maya Elazar, Rotem Ben-Zeev, Dana Lehavi-Regev, Meirav N. Katz, Meirav Pevsner-Fischer, Arieh Gertler,4 Zamir Halpern, Alon Harmelin, Suhail Aamar,Patricia Serradas, Alexandra Grosfeld, Hagit Shapiro, Benjamin Geiger, Eran Elina. Hyperglycemia drives intestinal barrier dysfunction and risk for enteric infection. Science du 8 mars 2018 DOI: 10.1126/science.aar3318
Auteur : Docteur Sophie Duméry
Crédit photo Adobe stock